Metateza
Metateza (łac. metathesis, z gr. μετάθεσις metáthesis = przestawienie)[1][2] – reakcja chemiczna przebiegająca według ogólnego schematu:
- A−B + C−D ⇌ A−D + C−B
W wyniku tej reakcji fragmenty reagujących cząsteczek "zamieniają się miejscami" w skoordynowany sposób.
Metateza w chemii nieorganicznej
W chemii nieorganicznej reakcje metatezy znane są zazwyczaj pod nazwą reakcji podwójnej wymiany[3]. Należą do nich. m.in. reakcje zobojętniania i strącania, np.
Metateza olefin
Definicja i omówienie
Metateza olefin to reakcja między alkenami, alkinami lub ich pochodnymi, w których istnieją wielokrotne wiązania węgiel-węgiel (tzw. olefiny, czyli węglowodory nienasycone). W wyniku tej reakcji następuje skoordynowane pękanie dwóch wiązań podwójnych między atomami węgla z utworzeniem dwóch innych wiązań podwójnych lub układu cyklicznego:
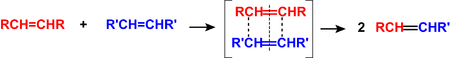
Duże praktyczne znaczenie ma metateza dysproporcjonująca olefin, zwana metatezą krzyżową, (CM, z ang. cross-metathesis):
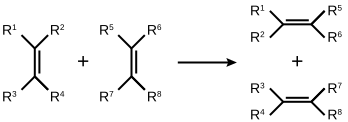
Jest ona stosowana w przemyśle rafineryjnym do zwiększania liczby oktanowej surowej benzyny. Reakcję tę w przemyśle rafineryjnym prowadzi się w wysokiej temperaturze, z użyciem katalizatorów wolframowych (np: WCl6–EtOH–EtAlCl2). Na skutek reakcji metatezy mieszaniny alkenów obecnych w destylacie z ropy naftowej powstają rozgałęzione alkany, które mają wysokie liczby oktanowe i wzbogacają surową benzynę. Proces ten został opracowany przez firmę Shell i jest znany jako „SHOP” (z ang. Shell higher olefin process).
Inną reakcją o dużym praktycznym zastosowaniu jest ROMP (z ang. ring opening metathesis polymerisation), czyli polimeryzacja przez metatezę z otwarciem pierścienia (polimeryzacja z metatetycznym otwarciem pierścienia):

Dzięki tej reakcji stało się możliwe uzyskanie wielu poliolefin, których nie można było otrzymać w wyniku zwykłej polimeryzacji winylowej. Poliolefiny te są stosowane m.in. jako powłoki płyt CD i powłoki zabezpieczające powierzchnie natarcia skrzydeł samolotowych.
Reakcja metatezy jest też bardzo wygodnym sposobem otrzymywania czynnych optycznie związków chemicznych, których nie można otrzymać w inny sposób, co rozszerzyło znacznie metody dostępne w ramach syntezy asymetrycznej:

Mechanizm reakcji
Jakkolwiek reakcja metatezy olefin znana jest od ponad stu lat, bardzo długo nie potrafiono jej kontrolować, gdyż nie znano jej mechanizmu. Wzmożone zainteresowanie metatezą w chemii organicznej pojawiło się w latach 60. XX w. i było związane z odkryciem kompleksów alkilidenowych, które okazały się świetnymi katalizatorami tej reakcji i umożliwiły dogłębne zbadanie jej mechanizmu. Są to tzw. katalizatory Schrocka i katalizatory Grubbsa.
Mechanizm ten, niezależnie od typu metatezy, polega w pierwszym etapie na tworzeniu się in situ metaloorganicznych kompleksów alkilidenowych. W drugim etapie kompleks ten reaguje z wolnym alkenem (w reakcji cykloaddycji [2+2]) tworząc nietrwały, choć możliwy do spektroskopowego zaobserwowania, układ metalacyklobutanowy, który rozpada się (wskutek cyklorewersji [2+2]) z utworzeniem dwóch nowych wiązań podwójnych węgiel-węgiel:

Klasyfikacja metatezy olefin
Rodzina reakcji metatezy olefin obejmuje:
- metatezę krzyżową (dysproporcjonującą) – cross-metathesis (CM)
- metatezę z zamknięciem pierścienia – ring-closing metathesis (RCM)
- metatezę enynową (EM)
- metatezę z otwarciem pierścienia – ring-opening metathesis (ROM) i jej wersję prowadzącą do polimeryzacji: polimeryzację z metatetycznym otwarciem pierścienia – ring-opening metathesis polymerization (ROMP)
- acykliczną metatezę dienów (ADMET), która również ma swą "wersję" polimeryczną
- metatezę alkinów (AM)
Historia
Reakcję metatezy odkrył w latach 50. XX w. Karl Ziegler. Jednak, dopiero Yves Chauvin w 1971 roku podał jej szczegółowy mechanizm i określił katalizujące ją metale. W 1967 roku Calderon jako pierwszy użył terminu metateza olefin, który zastąpił określenie dysproporcjonowanie. W 1990 Richard Schrock opracował katalizatory reakcji w oparciu o molibden i prazeodym (tzw. katalizatory molibdenowe Schrocka), a profesor Robert Grubbs dwa lata później (w 1992) otrzymał katalizator rutenowy (katalizatory tego typu znane są obecnie jako katalizatory Grubbsa), który umożliwia przeprowadzenie bardzo wydajnych reakcji metatezy w roztworze. Dzięki wprowadzonym do metatezy katalizatorom rutenowym, jest to niezwykle efektywna metoda syntetyczna. Umożliwia ona m.in. syntezę leków, tworzyw sztucznych, herbicydów, dodatków do paliw oraz feromonów. Metoda metatezy służy do zamykania dużych pierścieni i tworzenia długich łańcuchów.
W roku 2005 Chauvin, Schrock i Grubbs otrzymali nagrodę Nobla w dziedzinie chemii[5].
Metateza wiązań σ
Metateza wiązań σ, która zachodzi w przypadku wielu związków metaloorganicznych jest reakcją analogiczną do metatezy olefin, w której zamiast pękania i powstawania wiązań podwójnych węgiel-węgiel dochodzi do wymiany wiązań pojedynczych węgiel-metal i węgiel-wodór lub wodór-wodór:

Reakcji tej ulegają szczególnie chętnie kompleksy cyklopentadienylowe (Cp) tzw. wczesnych metali przejściowych, tj. znajdujących się w grupach 3 (wraz z lantanowcami), 4 i 5 układu okresowego pierwiastków. Dla tego rodzaju związków reakcja ta zachodzi spontanicznie i ma charakter równowagowy.
Mimo pozornego podobieństwa, reakcja ta ma jednak inny mechanizm niż reakcja metatezy olefin i jest on obecnie[kiedy?] jeszcze nie do końca zrozumiany. Jest to jedna z nielicznych reakcji metaloorganicznych, które zachodzą bez żadnej zmiany stopnia utlenienia metalu centralnego. Ze względu na to, że wczesne metale przejściowe w kompleksach Cp i tak już mają maksymalne, dostępne dla nich stopnie utleniania, mechanizm metatezy wiązań σ nie może zachodzić według klasycznego dla chemii metaloorganicznej mechanizmu z udziałem etapu utleniającej addycji i reduktywnej eliminacji.
Metateza wiązań σ jako samodzielna reakcja chemiczna nie ma zbyt wielu zastosowań. Stosuje się ją czasem do wymiany ligandów w celu uaktywnienia „uśpionego” katalizatora metaloorganicznego. Reakcja ta występuje jednak jako jeden z etapów mechanizmu reakcji wielu procesów stosowanych na skalę przemysłową, m.in. hydrosililowania i polimeryzacji winylowej z użyciem katalizatorów metaloorganicznych.
Przypisy
- ↑ Władysław Kopaliński: metateza. [w:] Słownik wyrazów obcych i zwrotów obcojęzycznych [on-line]. slownik-online.pl. [zarchiwizowane z tego adresu (2013-07-02)].
- ↑ Henry George Liddell, Robert Scott: μετάθεσις. [w:] A Greek-English Lexicon [on-line]. [dostęp 2018-07-16]. (ang.).
- ↑ Mały słownik chemiczny, Wiedza Powszechna, Warszawa, 1971
- ↑ Van Veldhuizen, Joshua J., Garber, Steven B., Kingsbury, Jason S., Hoveyda, Amir H.. A Recyclable Chiral Ru Catalyst for Enantioselective Olefin Metathesis. Efficient Catalytic Asymmetric Ring-Opening/Cross Metathesis in Air. „Journal of the American Chemical Society”. 124 (18), s. 4954–4955, 2002. DOI: 10.1021/ja020259c.
- ↑ The Nobel Prize in Chemistry 2005. Nobelprize.org, 2005. [dostęp 2014-11-07].
Bibliografia
- Handbook of Metathesis. Robert H. Grubbs (red.). Weinheim: Wiley-VCH, 2008. DOI: 10.1002/9783527619481. ISBN 978-3-527-61948-1.
- A. Maureen Rouhi. Olefin Metathesis: The Early Days. „Chemical & Engineering News”. 80 (51), s. 34–38, 2002.
- Dragutan, Ileana, Dragutan, Valerian, Filip, Petru. Recent developments in design and synthesis of well-defined ruthenium metathesis catalysts – a highly successful opening for intricate organic synthesis. „Arkivoc”, s. 105-129, 2005.